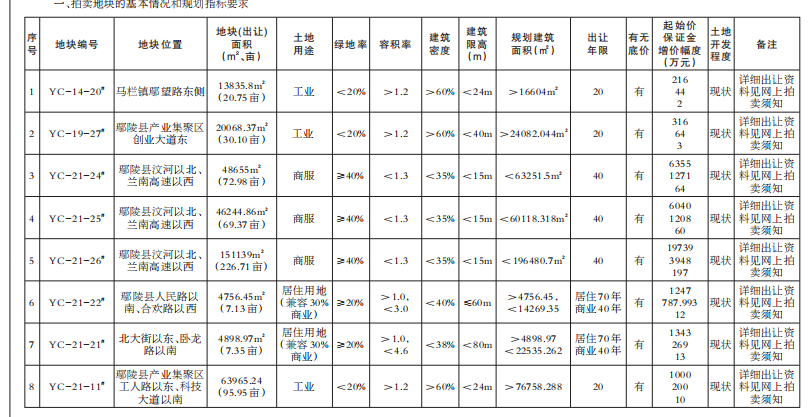
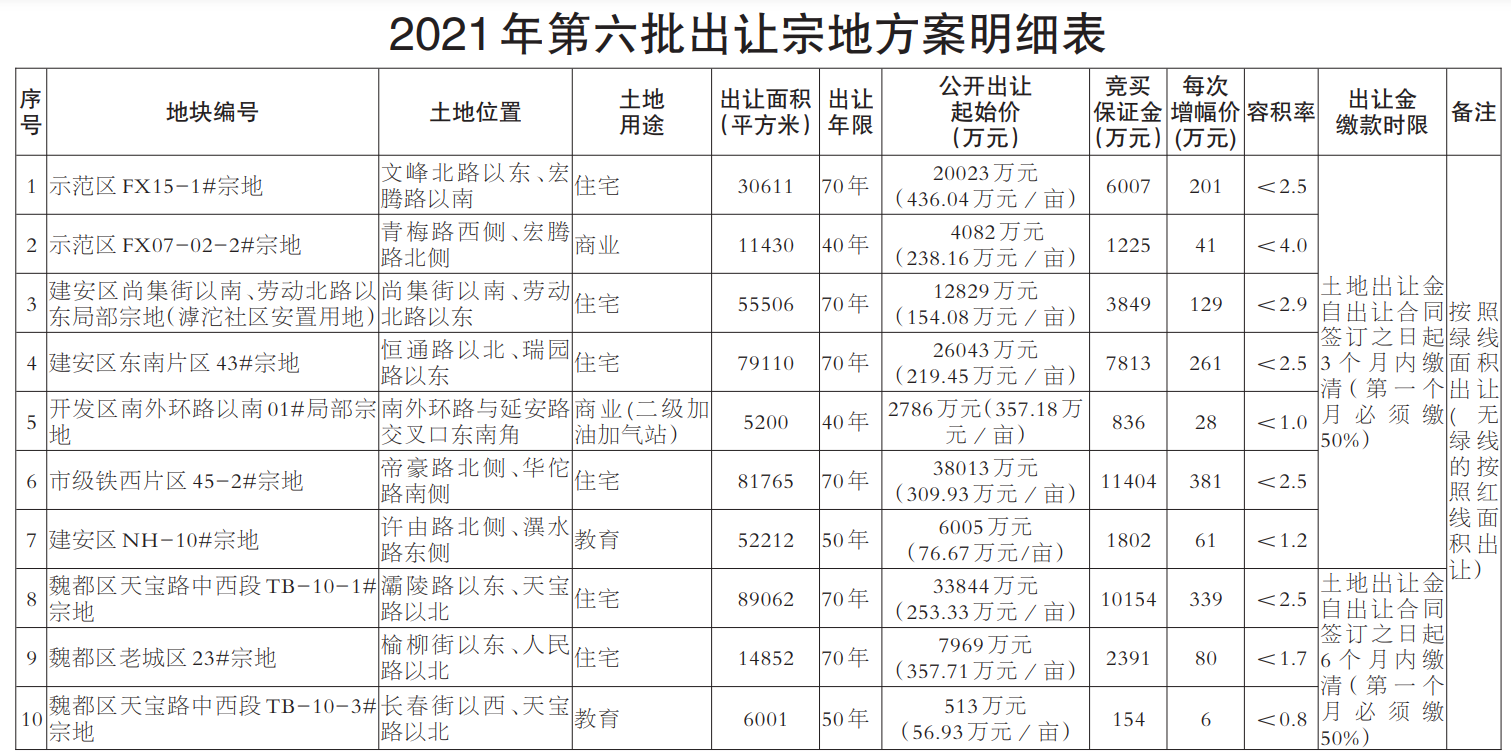
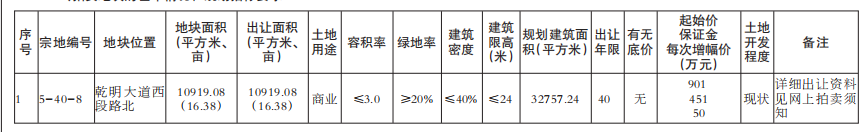
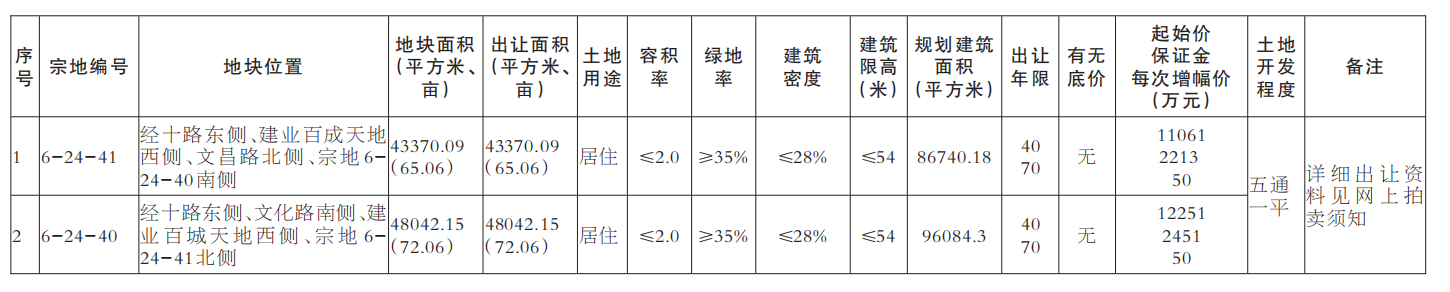
一部爆火的《我不是藥神》將公眾的視線拉到了印度仿制藥上面,但實際上,在這之前印度仿制藥的地位幾乎已經(jīng)在癌癥患者的世界里“封神”。回望印度仿制藥發(fā)展的來路,從政府的“強行合法”到藥企的借勢崛起,“印度格列寧”引起的軒然大波不僅僅只是一個巧合的個案,反而更像是印度藥企的一個縮影。
“格列寧”的原型
《我不是藥神》里的“格列寧”成了貫穿電影的一條主線,而聚焦了太多人關(guān)注的“印度格列寧”的原型,實際上是印度知名的制藥集團NATCO生產(chǎn)的慢粒白血病“特效藥”VEENAT,俗稱“印度格列衛(wèi)”。據(jù)了解,NATCO生產(chǎn)的藥品幾乎與瑞士諾華制藥生產(chǎn)的原研藥格列衛(wèi)的成分及有效含量完全一致。相比瑞士諾華2.5萬元一瓶的格列衛(wèi),NATCO的仿制藥價格僅有980元。
本就是山寨來的生意自然不會出現(xiàn)壟斷的跡象。印度最大的制藥企業(yè)太陽制藥、路平制藥(Lupin)、格蘭馬克(Glenmark)、西普拉(CIPLA)等著名藥企都有仿制類似的格列衛(wèi)。而真正讓NATCO火了的也不僅僅只是這部電影,還有早前該公司仿制出的肺癌靶向藥物及肝癌靶向藥物易瑞沙和多吉美。
此前,德國拜耳研制出癌癥專利藥物多吉美,但使用該藥物的成本每月超過5000美元,而在2014年,印度人均國民收入也只有1570美元。因此,2012年,印度政府給NATCO開了綠燈,為NATCO頒布了首個藥物專利強制需求證書,允許NATCO生產(chǎn)多吉美。
易瑞沙與多吉美無二,本是英國制藥公司阿斯利康的專利產(chǎn)品,而NATCO只是根據(jù)印度當(dāng)局授權(quán)的易瑞沙藥品仿制許可進行仿制。由于藥品成分與生產(chǎn)工藝幾乎完全一致,省去了研發(fā)投入的印度版易瑞沙售價僅為英版易瑞沙的1/8,這使得易瑞沙成為仿制藥的寵兒,也因此成為NATCO利潤的主要來源之一。
進擊的NATCO沒有停止仿制的步伐。2015年12月,NATCO宣布即將上市的丙肝C型仿制藥28片的售價僅為28000盧比,而原版專利藥在美國的售價卻達到了9萬美元。更重要的是,目前取得生產(chǎn)該藥物仿制藥許可的印度廠家已經(jīng)不下10家。
在這場仿制藥的紅海里,NATCO已經(jīng)成為了印度藥企的一個縮影。截至2015年,印度已有10500個制藥單元,3000多家藥企,而仿制藥在印度藥品市場的占比已經(jīng)達到了70%左右。預(yù)計到2020年,印度仿制藥出口額將達到400億美元。

“山寨”的法寶
NATCO只是印度藥企的冰山一角。作為世界第三大仿制藥生產(chǎn)大國,眾多藥企已經(jīng)成為印度經(jīng)濟里不可或缺的一個支柱,由于生產(chǎn)了全球20%的仿制藥,也因此一度被成為是“世界藥廠”。而NATCO雖然不是印度數(shù)一數(shù)二的頂尖藥企,但NATCO的發(fā)家史或許能夠稱得上是印度藥企發(fā)展模式的一個模型。
因為廉價藥而挫敗西方國家的產(chǎn)品,再在這個基礎(chǔ)上向海外市場擴張。雖然這個有些“野”的路子飽受世界非議,但“抓到耗子就是好貓”的邏輯確實為印度帶來了可觀的利潤。數(shù)據(jù)顯示,2017年印度藥品市場規(guī)模已達到296.1億美元,預(yù)計2011-2020年印度藥品市場將保持11.3%的年均增速。到2020年,印度藥品市場規(guī)模可能達到550億美元。
印度最大的制藥企業(yè)太陽制藥就是這個改編版“青出于藍而勝于藍”的典型。生于醫(yī)藥世家的Dilip用父親資助的第一筆投資——1萬盧比開始了白手起家的征程,1982年,Dilip創(chuàng)辦了太陽制藥,第一批生產(chǎn)的藥品就是五種精神病用藥。
避開了國際上的熱點用藥,太陽制藥選擇了開辟精神病、神經(jīng)病、心血管、癌癥等慢性疾病的領(lǐng)土,在細(xì)分市場下苦功夫。而在國內(nèi)政策的支持下,太陽制藥也終于開啟了國際化的征程。但太陽制藥選擇的卻不是在世界各地建工廠,而是通過兼并來擴大自己的商業(yè)版圖。
1996年,太陽制藥首次收購了跨國制藥公司Knoll的Ahmednagar,并對其進行改造以通過審批。一年之后,太陽制藥又收購了TamilNaduDadhaPharmaceuticals專注生產(chǎn)抗癌藥物。同年,它又以750萬美元的價格收購了美國底特律的Caraco藥廠,從而進入了美國市場。2015年3月,印度高等法院批準(zhǔn)太陽制藥收購蘭伯西實驗室,這意味著兩家印度最大制藥公司的合并完成,印度最大的一家制藥企業(yè)也正式面世。至今,太陽制藥已收購了16家公司。
而印度仿制藥企業(yè)之所以能夠立足于世界,也不僅僅是策略的功勞,更重要的還是品質(zhì)的保證。印度第二大制藥企業(yè)雷迪制藥或許能夠很好地說明這一點。自主開發(fā)頗具影響力的止痛藥物是雷迪制藥在印度市場安身立命的資本,而在印度政府的扶持下,雷迪制藥也開始緊跟潮流第一時間開發(fā)全球暢銷的仿制藥。
2001年,雷迪公司開發(fā)的40mg劑量的百憂解片成為該公司第一個進入美國市場的首仿藥,這也是印度企業(yè)進入美國仿制藥市場上的第一個首仿藥。而這一首仿藥之所以能夠誕生,也有賴于雷迪公司在美國多年的市場研發(fā)調(diào)查。
來自世界的“黃牌”
成也蕭何敗蕭何。今年5月,由于存在質(zhì)量上的風(fēng)險,中國國家藥監(jiān)局發(fā)布公告稱,自5月14日起在中國境內(nèi)暫停銷售印度太陽藥業(yè)生產(chǎn)的注射用亞胺培南西司他丁鈉。
而這也不是太陽制藥首次面臨質(zhì)量危機。去年末,美國食品藥品監(jiān)督管理局(FDA)發(fā)布了一則藥品召回新聞,稱由于受到微生物污染,太陽制藥自愿召回部分產(chǎn)品。而在2015年末,太陽制藥的哈洛爾工廠就已經(jīng)收到FDA的警告信,哈洛爾工廠正是太陽制藥在美國的最大銷售廠商。去年年中的數(shù)據(jù)顯示,太陽制藥的創(chuàng)始人身價已經(jīng)跌至111億美元,與其頂峰時相比,縮水了56%。
樹大招風(fēng),美歐國家的黃牌警告越來越多。從瑞士諾華因為格列衛(wèi)的仿制而起訴印度政府那一刻開始,這個世界藥廠就已經(jīng)被其他國家盯上了。自從2014年5月,以色列仿制藥企業(yè)梯瓦制藥召回了近4萬瓶由其印度供應(yīng)商Emcure公司生產(chǎn)的藥品至今,已有6家印度制藥企業(yè)被FDA列入了黑名單。而據(jù)《經(jīng)濟學(xué)人》報道,自2015年以來,太陽制藥旗下的大型工廠就一直都無法向美國出口新藥。
印度政府不得不出手了。去年8月,印度專利局決定授予美國輝瑞公司肺炎疫苗Prevenar13的專利權(quán),同時禁止其他公司制造更便宜的疫苗副本,并且允許輝瑞公司直到2026年,在印度都擁有獨家銷售權(quán)。這意味著在專利保護日益趨嚴(yán)的大背景下,印度政府已經(jīng)透露出服軟的跡象,未來印度仿制藥企業(yè)的挑戰(zhàn)可想而知。
除此之外,激烈的市場競爭也開始迎面撲來。此前《經(jīng)濟學(xué)人》的報道中提及,F(xiàn)DA正在以創(chuàng)紀(jì)錄的速度來批準(zhǔn)更多的外國藥物出口至美國,來削弱印度制藥公司的競爭力,限制其定價能力。印度仿制藥最近一個季度的利潤已比一年前下降了三分之一,分析師預(yù)計印度仿制藥在美國的利潤每年會削減10%左右。另一邊,評估印度制藥公司表現(xiàn)的Nifty制藥指數(shù)也在兩年內(nèi)下跌了近四分之一。
仿制藥的路越來越窄,印度制藥開始著手創(chuàng)新了。據(jù)了解,印度七大實驗室每年在創(chuàng)新方面的總投資額約為15億美元,研究與開發(fā)的成本在不斷攀升。而印度在創(chuàng)新藥的研發(fā)上面也有一定的基礎(chǔ),據(jù)了解,印度自行研制的藥物有110項得到美國FDA的批準(zhǔn),包含40項藥品制劑及70項原料藥,歐盟批準(zhǔn)有75項,南非等其他非洲國家有100項。
北京商報記者陶鳳楊月涵
-
深圳一男子加油站拔油槍點燃后逃跑 警方已介入調(diào)查縱火人員已鎖定
頭條 21-12-17
-
這位感動千萬抖音網(wǎng)友的河南“留蝦女孩” 入選央視年度短片《2021看見笑容》
頭條 21-12-17
-
淚目!95歲媽媽病床前親吻74歲生病的女兒 網(wǎng)友:孩子不管多大都是媽媽的寶貝
頭條 21-12-15
-
川妹子抽中50顆榴蓮直呼吃不完!網(wǎng)友:可以共享你的負(fù)擔(dān)嗎?
頭條 21-12-15
-
河南省政府發(fā)布2022年元旦放假通知
頭條 21-12-15
-
濮陽市聚碳新材料產(chǎn)業(yè)聯(lián)盟成立
頭條 21-12-15
-
周口機場預(yù)計什么時候建好?都有到哪些城市的航線?官方回復(fù)來了
頭條 21-12-15
-
預(yù)計明年超50家企業(yè)回歸,瑞銀稱中概股H股上市將繼續(xù)升溫
頭條 21-12-15
-
新鄉(xiāng)發(fā)現(xiàn)一境外輸入奧密克戎病例密接者,活動軌跡公布
頭條 21-12-15
-
河南:中藥配方顆粒不得在醫(yī)療機構(gòu)以外銷售
頭條 21-12-15
-
中原環(huán)保完成發(fā)行5億元超短融,利率2.95%
頭條 21-12-15
-
南陽市政府將與中車四方所在新能源裝備等領(lǐng)域開展深入合作
頭條 21-12-15
-
鄭州出臺新措施:公租房可“掌上”繳租秒辦理
頭條 21-12-15
-
國家統(tǒng)計局:11月社會消費品零售總額增長3.9%
頭條 21-12-15
-
中國11月規(guī)上工業(yè)增加值同比增長3.8%
頭條 21-12-15
-
1207萬!全年就業(yè)超額完成預(yù)期目標(biāo)
頭條 21-12-15
-
河南凱旺科技公開發(fā)行2396萬股新股,獲6321.47倍申購
頭條 21-12-15
-
事關(guān)貨幣政策、房地產(chǎn)、全面注冊制,一行兩會劃定明年工作重點
頭條 21-12-15
-
隔夜歐美·12月15日
頭條 21-12-15
-
多部委密集部署明年工作!三大看點值得關(guān)注
頭條 21-12-15
-
立方風(fēng)控鳥·早報(12月15日)
頭條 21-12-15
-
醫(yī)藥巨頭今日登陸科創(chuàng)板!高瓴重倉"陪伴",引入"綠鞋"機制
頭條 21-12-15
-
皮海洲:臨門一腳踏剎車!龍竹科技終止轉(zhuǎn)板說明了什么
頭條 21-12-15
-
立方風(fēng)控鳥·晚報(12月14日)
頭條 21-12-14
-
總投資額超百億!中建七局接連中標(biāo)兩個EPC總承包項目
頭條 21-12-14
-
2022年部分地方債提前下達,財政提前發(fā)力穩(wěn)經(jīng)濟
頭條 21-12-14
-
信陽華信投資集團10億元中票完成發(fā)行,利率3.70%
頭條 21-12-14
-
新強聯(lián)擬擇機出售所持明陽智能股票
頭條 21-12-14
-
洛陽新強聯(lián)擬億元入股山東擬IPO公司,持股4.50%
頭條 21-12-14
-
焦作在這場推介會上現(xiàn)場簽約28個項目,總投資240億元
頭條 21-12-14
-
河南7種輕微交通違法可免罰
頭條 21-12-14
-
浙江樂清民警自曝37歲未婚救下輕生女子 網(wǎng)友:一定要最愛自己
頭條 21-12-14
-
畫面感太強!主人出差貓咪打開水龍頭把家淹了 網(wǎng)友:當(dāng)然是原諒它
頭條 21-12-09
-
8歲雙胞胎姐妹玩捉迷藏?fù)斓?0萬擺地攤媽媽報警找失主 網(wǎng)友紛紛點贊
頭條 21-12-08
-
女子9樓墜落緊緊抓住7樓防護窗所幸有驚無險!網(wǎng)友:不幸中的萬幸啊
頭條 21-12-07
-
江西一年級萌娃穿航天服走方陣 網(wǎng)友:可可愛愛的小小航天員
頭條 21-12-06
-
女子精心養(yǎng)了半年的盆栽竟是塑料做的 網(wǎng)友:這是做的有多真
頭條 21-11-30
-
河南鄭州一女子懷上八胞胎!醫(yī)生一句話說出罕見原因 全家又喜又憂
頭條 21-11-26
-
神奇!女子用砂鍋煮綠豆粥自動吐皮 網(wǎng)友:這個鍋好“懂事”
頭條 21-11-23
-
湖南一懷孕老師暈倒學(xué)生們立刻化身“閃電俠”飛奔相救
頭條 21-11-23
-
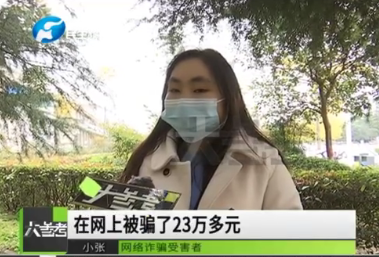
26歲癌癥女孩刷單被騙23萬救命錢 想掙外快結(jié)果救命錢打了水漂
頭條 21-11-23
-
河南鄭州六旬白發(fā)教授夜訪男寢教微積分:都追到宿舍再學(xué)不會就對不起老師
頭條 21-11-19
-
男子撿槍上交進門瞬間嚇壞警察迅速拔槍警戒 網(wǎng)友:進門倒是說一聲啊
頭條 21-11-19
-
硬核!男子酒后執(zhí)意開車被兄弟卸掉輪胎 網(wǎng)友:這才是真朋友啊!
頭條 21-11-18
-
撒貝寧時隔4年回歸主持今日說法 網(wǎng)友激動喊話:“爺青回”
頭條 21-11-18
-
廣州一流浪貓被五星級酒店收留憑實力找到長期飯票 每天吃米其林星級員工餐
頭條 21-11-17
-
經(jīng)商奇才!長春女子為南方人雪地代寫6天賺300元 網(wǎng)友:雪起碼得分三成
頭條 21-11-16
-
實用又好看!陜西渭南村民在院墻上栽滿仙人掌防盜 網(wǎng)友:真的很好看~
頭條 21-11-15
-
果農(nóng)“為國家做研究”捐橘子 網(wǎng)店老板找到了!老板:大家理性消費
頭條 21-11-15
-
大烏龍!星空燈下男子捧花告白跪錯人 網(wǎng)友:社死現(xiàn)場!
頭條 21-11-15
- 顛覆級豪華改裝登場,風(fēng)行M7領(lǐng)爵款演繹豪華2021-12-20
- 借力清華大學(xué)課題研究 顧家家居與高校年輕2021-12-20
- 14萬起售即豪華,進階MPV世家煥新力作東風(fēng)2021-12-20
- 周口小學(xué)生被校長拍打頭部后病發(fā) 校長是否2021-12-20
- 太揪心!山西孝義透水事故獲救人員講述被困2021-12-20
- 國家衛(wèi)健委:昨日新增本土確診病例37例,其2021-12-20
- 浙江省新增確診病例12例,其中杭州市1例、2021-12-20
- 浙江昨日新增本土確診病例10例 境外輸入確2021-12-20
- 內(nèi)蒙古昨日新增境外輸入確診病例7例2021-12-20
- 香港特區(qū)政府新聞公報:行政長官林鄭月娥將2021-12-20
- 河南高純石英砂提純技術(shù)獲突破 提純二氧化2021-12-20
- 鄭州一年內(nèi)新增易貨公司100多家 靠收服務(wù)2021-12-20
- 出山店水庫移民安置工作通過國家驗收 歷時2021-12-20
- 鶴壁辛村遺址發(fā)現(xiàn)殷遺民貴族墓葬2021-12-20
- 河南省《通知》 確定175家企業(yè)為知識產(chǎn)權(quán)2021-12-20
- 河南出臺《方案》 到2025年公民具備科學(xué)素2021-12-20
- 11月份河南全省經(jīng)濟運行情況發(fā)布 新興動能2021-12-20
- 提醒!河南省2021年度文物勘探許可證年審工2021-12-20
- 2021年鄭州市家政服務(wù)機構(gòu)評級結(jié)果公布 142021-12-20
- 河南提前完成惠民惠農(nóng)財政補貼資金“一卡通2021-12-20
- 河南發(fā)文加快補齊全民健身場地設(shè)施短板 探2021-12-20
- 2021年度河南省體育產(chǎn)業(yè)示范單位示范項目評2021-12-20
- 河南省住房城鄉(xiāng)建設(shè)領(lǐng)域市場主體輕微違法行2021-12-20
- 鄭州各級醫(yī)保服務(wù)大廳重啟在即 首批可辦理2021-12-20
- 有效補充河南醫(yī)保 20多家共保公司聯(lián)合促成2021-12-20
- 8000年前河南裴李崗人開始用紅曲霉釀酒并儲2021-12-20
- 鄭州商都遺址博物院試開館 觀眾入館參觀需2021-12-20
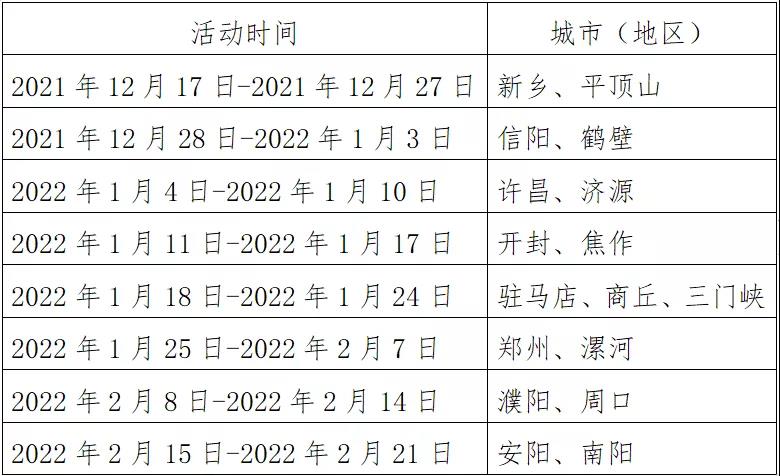
- 河南招才引智系列活動面向六座城市同時線上2021-12-20
- 重要提醒!河南省疾控中心緊急提醒2021-12-20
- 新安縣4A級以上景區(qū)對河南人免門票2021-12-20
精彩推薦
閱讀排行
- 河南高純石英砂提純技術(shù)獲突破 提純二氧化硅純度達到了99.998%
- 鶴壁辛村遺址發(fā)現(xiàn)殷遺民貴族墓葬
- 河南省《通知》 確定175家企業(yè)為知識產(chǎn)權(quán)強企
- 河南出臺《方案》 到2025年公民具備科學(xué)素質(zhì)比例將超15%
- 11月份河南全省經(jīng)濟運行情況發(fā)布 新興動能持續(xù)增強經(jīng)濟運行延續(xù)恢復(fù)態(tài)勢
- 提醒!河南省2021年度文物勘探許可證年審工作啟動
- 河南提前完成惠民惠農(nóng)財政補貼資金“一卡通”管理全年目標(biāo)
- 河南發(fā)文加快補齊全民健身場地設(shè)施短板 探索“體育+公園”新模式
- 2021年度河南省體育產(chǎn)業(yè)示范單位示范項目評選結(jié)果公示
- 河南省住房城鄉(xiāng)建設(shè)領(lǐng)域市場主體輕微違法行為免予處罰清單發(fā)布